为有序开展防疫物资出口、深化疫情防控国际合作、共同应对全球公共卫生危机,针对防疫物资的出口合规相关问题,我国海关总署与其他相关部门多次联合发布一系列公告和通知,进行动态调整,保证产品质量安全、规范出口秩序。其中最为重要的是商务部、海关总署、国家药品监督管理局公告2020年第5号(关于有序开展医疗物资出口的公告)(以下简称“5号公告”)、 海关总署公告2020年第53号(以下简称“53号公告”)、商务部、海关总署、国家市场监督管理总局公告2020年第12号(关于进⼀步加强防疫物资出口质量监管的公告)(以下简称“12号公告”),本文将结合上述三公告的内容,对防疫物资出口合规问题作出解析并提出建议。
一、5号公告内容和合规要求
3月31日,商务部、海关总署、国家药品监督管理局三部门联合发布了第5号公告。开始对5类重要防疫医用物资(新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计)在出口报关时进行严格监管。
具体要求企业针对上述5类防疫医用物资出口,需要做到:
1. 提供书面或电子声明,声明中包含国外质量标准名称、国外质量标准要求、进口国地区、生产厂商等信息。
2. 在声明中承诺出口产品已取得我国医疗器械产品注册证书,具体以国家药监局网站www.nmpa.gov.cn/WS04/CL2582/动态更新为准。
3. 在声明中承诺出口产品符合进口国(地区)的质量标准要求。
同时,对海关而言,海关凭药品监督管理部门批准的医疗器械产品注册证书验放。
二、53号公告内容和合规要求
随着国外对医用防疫物资的进口需求不断扩大,5号公告涉及的5类防疫医疗物资已不足以覆盖我国的出口物资种类。为了进一步加强医疗物资出口质量监管,依照《中华人民共和国进出口商品检验法》及其实施条例,海关总署于4月10日发布了53号公告,对“6307900010”等海关商品编号项下的医疗物资实施出口商品检验。
53号公告的附件中罗列了11个医用物资(医用口罩、医用防护服、呼吸机、红外体温计、医用手术帽、医用护目镜、医用手套、医用鞋套、病员监护仪、医用消毒巾、医用消毒剂),对应19个HS商品编号(部分商品因材质等其他原因导致对应有多个商品编号),海关仅对19个HS编号下涉及医用物资的商品实施出口商品检验。
三、12号公告内容和合规要求
一方面国外对于非医用防疫物资的进口需求在日益剧增,我国却没有配套的出口合规政策。另一方面,尽管海关总署通过5号、53号公告明确和补足了防疫医疗物资出口合规问题,但在实践中仍存在一些现实问题。例如有些商品虽然符合进口方的标准或合同约定,却因为不具备5号公告要求的医疗器械产品注册证书而无法出口。
面对亟需解决的困境,海关总署联合商务部与国家市场监督管理总局,于4月25日发布了关于进一步加强防疫物资出口质量监管的第12号公告。一来加强非医用口罩出口质量监管;二来对5号公告涉及的5类医用物资,作出补充规范要求。
(一)对非医用口罩合规要求
12号公告规定,自4月26日起,企业在与进口方签订的合同中应约定出口非医用口罩适用的质量标准,可以符合中国质量标准或国外质量标准,不同标准下合规要求不同,具体:
1. 非医用口罩出口企业提交电子或书面的出口方和进口方共同声明,确认产品符合中国质量标准或国外质量标准,进口方接受所购产品质量标准且不用于医用用途;
2. 当选择符合外国质量标准时,则企业在商务部确认取得国外标准认证或注册的非医用口罩生产企业清单内,具体以中国医药保健品进出口商会网站www.cccmhpie.org.cn动态更新为准(以下简称“白名单”);
3. 当选择符合中国质量标准时,企业不可以在市场监管总局提供国内市场查处的非医用口罩质量不合格产品和企业清单中,具体以市场监管总局网站www.samr.gov.cn动态更新为准(以下简称“黑名单”)。
针对4月26日前签订的非医用口罩出口合同,按公告发布之前的方式执行,生产企业不必在白名单内,但出口企业应当在报关时提交电子或书面的出口方和进口方共同声明。
(二)对5号公告涉及的5类医用物资,补充规范要求
5号公告发布后,部分企业虽未取得我国医疗器械产品注册证书,但其欲出口且属于5号公告涉及的5类医疗物资,已获得国外标准认证或注册。12号公告针对这一情况,进行了报关材料的合规补充。
12号公告规定,自4月26日起,取得国外标准认证或注册的新型冠状病毒检测试剂、医用口罩、医用防护服、呼吸机、红外体温计的出口企业,报关时须提交书面声明,承诺产品符合进口国(地区)质量标准和安全要求,海关凭商务部提供的白名单验放。
四、违规可能涉及的法律后果
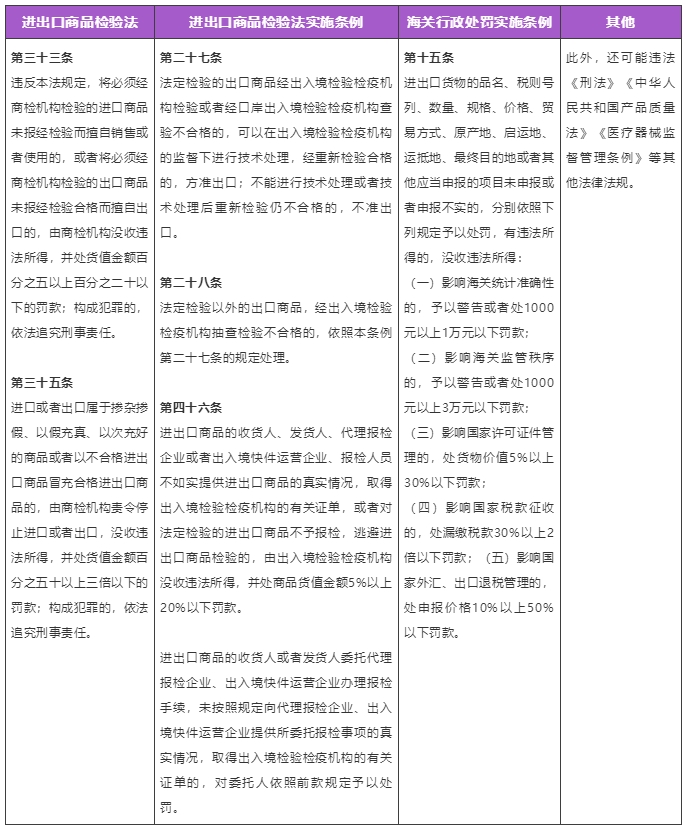
五、合规总结和对企业的建议
从5号公告到12号公告,合规调整对象逐渐扩大,从医用物资涵盖到非医用物资;合规内容也在不断细致化、完善化、严格化,以动态的调整应对不断扩大的出口需求和解决国内外防疫物资标准多样化的矛盾。实际上,公告发布后,海关通过各个官方信息平台,也对一些实践问题给予了解决思路。比如当企业的医疗器械产品是进口复出口时,可以无需提供医疗注册许可证,而提供由药品监督管理部门批准出具的进口医疗注册证明即可;对于新型冠状病毒检测试剂这一特殊医用物资,除了按照公告要求外,企业在报关时,发货人应当申请卫生检疫审批,凭《入/出境特殊物品卫生检疫审批单》通过单一窗口报检并提供药监部门出具的出口销售证明。然而,即使三公告和后续的政策解读给出了一些指导,不可避免的是,实践中仍然有许多问题尚待解决。比如12号公告白名单不详尽,企业想申请却耗时长;12号公告黑、白名单同时符合情况下,各地海关执法尺度不一等问题尚未得到妥善解决。
尽管医疗物资的质量安全监管问题事关重大,需要严格规定,但从三公告的合规要求以及相关部门后续的回应中发现,对出口防疫物资的质量标准,企业可以与进口方在合同中进行约定选择,这显示企业依然留有一定自主权力。
此外,三公告不仅对出口的医疗物资质量进行核验和安全监管,也意在预防未来可能会产生的国际贸易争端。通过“出口声明”的方式,提前厘清和明确中国出口企业所承担的保障防疫物资质量的责任,与进口企业或者进口国家、地区相关政府部门的责任进行关联。
对此,我们除了期待法律法规在实操层面进一步的完善,也提醒和建议广大出口,从如下角度规范自身法律风险:
1. 与进口企业进行沟通,签订合同中明确相关标准、权利义务,调整合同内容以适应中国的出口合规;
2. 严格遵守涉及出口合规的公告要求,依规定提交材料,对政策尺度把握不精准的,切勿铤而走险打“擦边球”;
3. 除对上述三公告的掌握外,时刻关注海关总署发布的合规通知以及各相关规定,比如海关总署更新发布的《部分国家(地区)防疫物资技术法规和标准要求》等,进行动态的调整;
4. 对政策把握不明晰、遇到被海关查验或对商品监管存有争议时,可寻求有经验的律师为企业进行判断,进而争取合法权益。

